電気防食とは
まえがき
電気防食を試みたのは Sir Humphery Davyであるとされ、約200年の歴史と実績を有する確実な防食工法です。
防食の歴史は1824年に、木造軍艦の船体外板に張られた銅板の腐食を防止する為に、小さな亜鉛或いは鉄のブロックを犠牲陽極としてテストした事が起源と言われています。
日本では昭和30年頃(1955年頃)から急速な進歩を遂げた技術の一つであり、諸外国の進歩に負う所も多くありますが、日本独自に開発された防食技術も多くあります。
弊社は防食技術の専門会社として日本で最初に創業し、日本の防食技術を担ってきました。
電気防食法には陰極防食法(カソード防食法)と陽極防食法(アノード防食法)がありますが、陽極防食法は特殊な環境で使用され、実施例はありません。これに対し、陰極防食法は船舶、港湾施設、埋設配管等広範囲に使用されていることから、電気防食といえば陰極防食法を指すことが主流となっております。
対象となるのは電解質(水・土壌・コンクリートなどの電気を通す物質)中に存在する金属で、鉄鋼の他にアルミニウム合金、ステンレス鋼、鉛、銅合金などがあります。
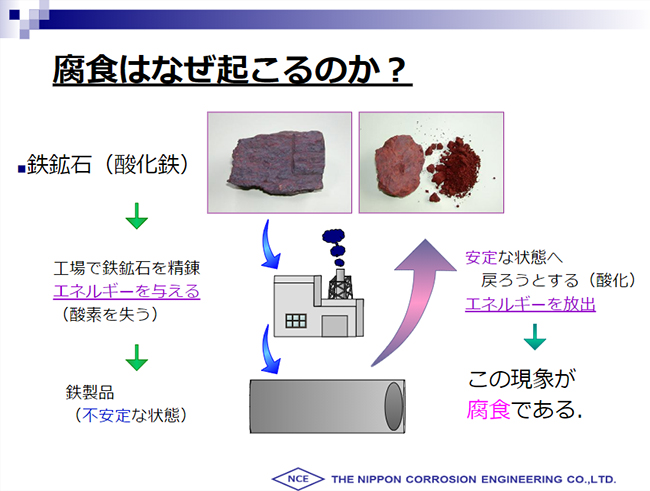
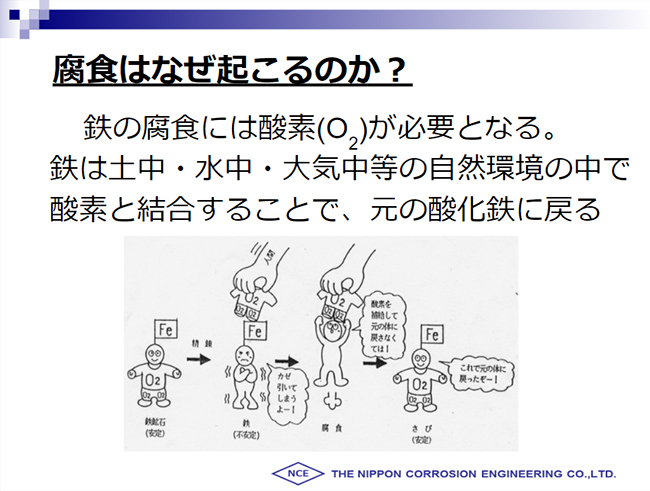
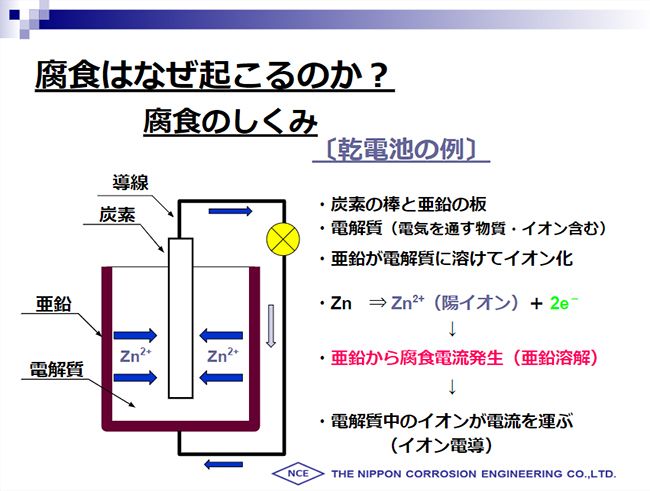
金属の腐食とは

電気防食方式の種類
流電陽極方式
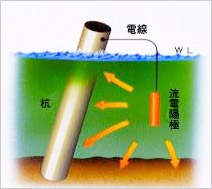
海水中や土中などの電解質中にある被防食体よりもアルミニウム、亜鉛、マグネシウムのようなイオン化傾向の大きい金属を接続し、両者間の電位差を利用して被防食体に防食電流を流す方式を流電陽極方式といいます。
外部電源方式
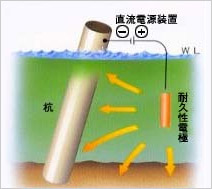
直流電源装置と耐久性電極を用い、直流電源装置のプラス極を電解質中に設置した耐久性電極に接続し、マイナス極を被防食体に接続して防食電流を通電する方式を外部電源方式といいます。
選択排流方式
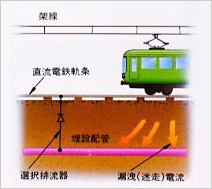
直流電鉄軌条からの漏洩電流(迷走電流)により埋設配管が電食を受けている場所に、漏洩電流を軌条に戻すための選択排流器を設置し、軌条と埋設管を接続して電食を防止する方法を選択排流方式といいます。











